
El país alcanzó récords tanto en procesos de donación como en trasplantes realizados, superando los registros previos a la pandemia
Las disposiciones publicadas en el Boletín Oficial alcanzan aceites adulterados, un medicamento sin registro y una solución fisiológica con desvíos críticos. El organismo alertó a la población y ordenó el retiro inmediato de los productos del mercado.
Salud04/11/2025
⚠️ Solución fisiológica RIGECIN: envases no autorizados y riesgo grave para la salud
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) prohibió el uso, distribución y comercialización en todo el país de dos lotes del producto “Solución Fisiológica Isotónica RIGECIN 0,90% / Cloruro de Sodio”, tras detectarse desvíos de calidad críticos que podrían representar un riesgo grave o potencialmente mortal para los pacientes.
La medida fue dispuesta mediante la Disposición 8187/2025, firmada el 30 de octubre de 2025 y publicada el lunes en el Boletín Oficial.
Según el expediente EX-2025-107379165-APN-INAME#ANMAT, el Departamento de Vigilancia Post Comercialización y Acciones Reguladoras del Instituto Nacional de Medicamentos (INAME) calificó el incidente como de nivel crítico y prioridad alta.
Durante la investigación se constató que los lotes NA5187 S2 (vto. 01/2027) y NA5675 S1 (vto. 04/2027) estaban envasados en un sistema no autorizado, abierto y de un solo puerto, lo que infringe la Disposición ANMAT Nº 11857-E/2017, que exige sistemas cerrados para soluciones parenterales de gran volumen.
Además, la empresa RIGECIN LABS S.A., con sede en la Ciudad de Buenos Aires, ya había sido suspendida preventivamente mediante la Disposición DI-2025-6202-APN-ANMAT#MS.
La ANMAT resolvió:
⚠️ Aceite “Valle de Beraca”: producto apócrifo y falsamente rotulado
Mediante la Disposición 8201/2025 (DI-2025-8201-APN-ANMAT#MS), la ANMAT prohibió la elaboración, fraccionamiento y comercialización del producto “Aceite de oliva extra virgen marca Valle de Beraca; contenido neto 2 Lts; Consumir antes AGO/27; RNE 13721946; RNPA 13203106”, al determinar que no cumple con la normativa alimentaria vigente.
El caso fue denunciado por el Instituto de Control y Bromatología (ICAB) de Entre Ríos, que verificó, mediante el Sistema de Información Federal para la Gestión del Control de los Alimentos (SIFeGA), que los números de RNE y RNPA eran inexistentes. Por ello, el producto fue considerado apócrifo y falsamente rotulado.
El Instituto Nacional de Alimentos (INAL) concluyó que el aceite carece de registros sanitarios de establecimiento y producto, infringiendo los artículos 3° de la Ley 18.284, 3° del Decreto 2126/71, y los artículos 6 bis y 13 del Código Alimentario Argentino (CAA).
Se prohibió también la venta de cualquier otro producto que use los números RNE 13721946 y/o RNPA 13203106, por ser falsamente rotulados.
⚠️ Aceite “Ecoliva”: falsamente rotulado y adulterado con soja
Otra disposición del mismo día, la 8202/2025 (DI-2025-8202-APN-ANMAT#MS), prohibió la venta del “Aceite comestible mezcla, libre de gluten marca Ecoliva, Blend, Cont. Neto 500 cm³”, elaborado por Desarrollo de Alimentos Naturales SRL.
El INAL analizó el producto y determinó que contenía aceite de soja refinado, pese a declarar un 90% de aceite de oliva y 10% de girasol. Además, incumplía el parámetro de acidez libre establecido por el Código Alimentario Argentino.
La ANMAT emitió una alerta nacional, recomendando a los consumidores abstenerse de utilizar el producto y a los comercios retirarlo de la venta. El caso fue catalogado como retiro Clase III (NIUR 0007/25).
⚠️ Medicamento “Tirzec”: sin registro y de origen desconocido
Finalmente, la Disposición 8203/2025 (DI-2025-8203-APN-ANMAT#MS) ordenó prohibir el uso, comercialización y distribución del producto “TIRZEC® 5, Tirzepatida 5mg/0,5 ml. 1 vial con 2ml de solución inyectable + 4 jeringas estériles con aguja, L 252092, V. 06/2027”, fabricado por QUIMFA S.A. (Asunción, Paraguay).
La investigación comenzó tras una denuncia sobre su venta en una farmacia de la provincia de Buenos Aires.
El medicamento no está registrado en el país ni cuenta con habilitación en el Registro de Especialidades Medicinales (REM), y su seguridad y eficacia son desconocidas.
La ANMAT advirtió que no puede garantizar su origen ni composición y pidió a profesionales y distribuidores verificar sus stocks, comunicándose al correo [email protected] o al 0800-333-1234.


El país alcanzó récords tanto en procesos de donación como en trasplantes realizados, superando los registros previos a la pandemia

“Ion – Bio Zapper”, “Ion Electrón – Ion Detox Spa” y “Ion Detox – Pediluvio Iónico” fueron suspendidos en su comercialización, distribución y publicación por carecer de registro, habilitación sanitaria y evidencias de eficacia.

Según el organismo sanitario, la PPA es una enfermedad viral de alto impacto socioeconómico y sanitario, considerada de notificación obligatoria internacional, y cuya introducción en el territorio argentino “representaría una amenaza grave e inminente”.

El organismo detectó la fabricación y circulación de productos domisanitarios sin registrar, rótulos no autorizados y tránsito interjurisdiccional. La empresa quedó inhibida y se inició un sumario sanitario.

La medida alcanza a limpiadores, desengrasantes y otros domisanitarios de la marca, que no contaban con registro ni habilitación. También se prohibió su publicidad y se notificó a autoridades sanitarias de todo el país.

Dispuso la prohibición de venta y consumo productos para el pelo de la marca PRODIGY, productos odontológicos de las empresas MDT S.A. Macrodent S.A y de la marca "Ventura".

La agencia detectó que los artículos no están registrados y advirtió que se desconoce su origen, fabricación y condiciones de seguridad.

La medida alcanza a productos de las marcas Caffé del Doge, Café Sol y Caffé del Ponte Rialto, que fueron considerados “apócrifos” por utilizar registros inexistentes.

El 77% de las personas que padecen EPOC no lo saben, una cifra que equivale a ocho de cada diez casos sin detectar. Hay una campaña nacional gratuita para saber si estás padeciendo la enfermedad.

Las consultas y pruebas gratuitas estarán disponibles en todos los Centros Municipales de Salud y en el Centro de Especialidades Médicas, donde un equipo de cuatro urólogos realizará las evaluaciones y controles.

El receso se extenderá hasta el 30 de enero de 2026, con suspensión de plazos procesales y atención mediante guardias

El requisito de controles sanitarios y vacunación se mantiene únicamente para niños y niñas de hasta 4 años inclusive, eliminando la obligación a niños y niñas de 5 años.

Comisiones de Trabajo y Presupuesto escucharon posturas enfrentadas sobre la reforma laboral. Tras duros cuestionamientos, el oficialismo acordó tratar el proyecto del Ejecutivo nacional en extraordinarias, en el mes de febrero.

La presentación en la Legislatura se realizó con problemas técnicos, sin directivos de la petrolera. YPF deja Tierra del Fuego con un déficit anual cercano a los 80 millones de dólares, mientras crece la preocupación por el futuro laboral de 500 trabajadores.

La medida fue formalizada mediante el Decreto 900/2025, firmado por el Presidente, el jefe de Gabinete Manuel Adorni y el ministro de Economía Luis Caputo, y autoriza la suscripción de un préstamo para el “Financiamiento adicional del Proyecto Apoyo a la Transición hacia Sectores de Electricidad y Gas Sostenibles”.
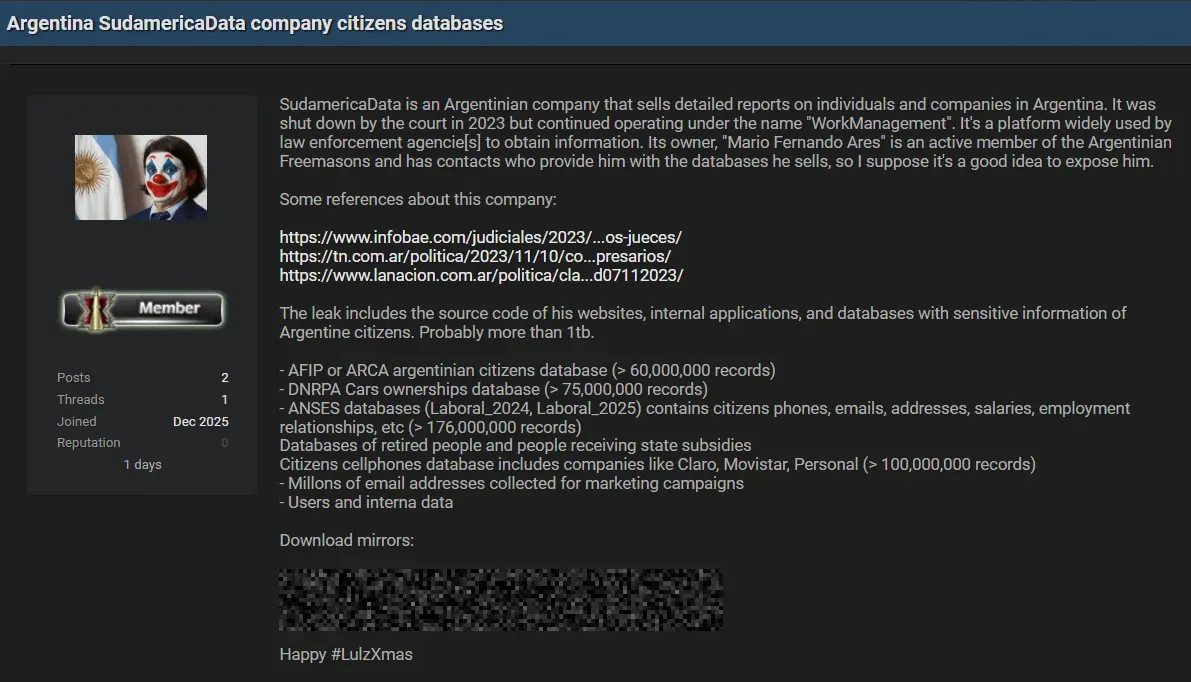
Más de un terabyte de información sensible habría sido expuesto en la dark web; ARCA negó cualquier vulneración de sus sistemas.